遺伝学の手法を用いた新しい抗がん剤やがんの転移を早期発見する検査手法の開発に取り組んでいます!
応用生物学部 生命科学・医薬品専攻 医薬品コース 村上優子 教授

薬剤師と医師の資格を持つ村上先生。遺伝学を用いて新しい抗がん剤やがんの新しい診断方法を開発しようと取り組んでいます。今回は、先生の研究室での取り組みについて、お話しいただきました。
■先生の研究室「腫瘍分子遺伝子学研究室」では、どのような研究に取り組んでいるのですか?
がんという病気を引き起こす原因を遺伝子やたんぱく質などの分子レベルで解明することや、それを通して抗がん剤の開発に貢献することを目的として研究しています。テーマとしては、大きく「新規分子標的薬開発」と「診断法開発」の2つに取り組んでいます。
まずは「新規分子標的薬開発」の取り組みから説明しましょう。これまでの抗がん剤は、がん細胞のどんどん増殖するという特徴を踏まえて、とにかく速い速度で増えている細胞を攻撃するという薬が主でした。そうすると細胞の選択性は少ないため、がん細胞に効くだけでなく、細胞分裂が活発な毛髪の細胞を攻撃して毛髪が抜けたり、細胞分裂が速い腸管の上皮細胞にも薬が効いて下痢を引き起こしたりという副作用がありました。そこで、がん細胞にしか効かない薬ができないものかと、がん細胞だけに見られる特異的に遺伝子が変化しているところを標的とした抗がん剤(分子標的薬)の開発が進められてきたのです。そのなかで、この研究室が取り組んでいるのは、“合成致死”という方法を用いて、がん細胞に特異的に効く薬をつくる研究です。
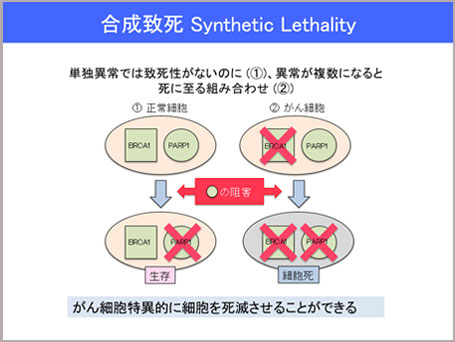
“合成致死”とは、遺伝子AとBの2つがあるときに、Aが異常をきたしてもBが正常であれば細胞は増え、逆にAは正常でBが変異しても、細胞は正常に分裂するのですが、AとBの両方に変異があるときだけ細胞が死ぬという現象のことです。
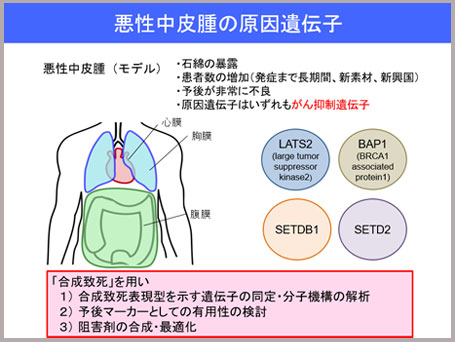
がんの増え方は、よく自動車に例えられます。がん細胞を増やすがん遺伝子は、いわばアクセルで、それが壊れることによりどんどん増殖するという増え方がひとつ。一方、がん抑制遺伝子というブレーキの役割をするものがあり、それが壊れることでがん細胞の分裂が止まらず、がん細胞が増えていくという増え方もあります。このうち、アクセルが壊れてがん細胞が増殖している場合は、アクセル自体を止めればよいので、薬もアクセルの阻害剤という形になります。薬は大抵が何かの阻害剤ですから割とつくりやすく、今ある抗がん剤の分子標的薬でも阻害剤はたくさんあります。ところがブレーキが壊れた場合、これを治療しようと思うと、新しいブレーキを入れなければなりません。ですから阻害剤というアプローチでは難しいため、がん抑制遺伝子が原因のがんに対しては、抗がん剤がつくりにくいのです。
私が研究対象としている悪性中皮腫というがんは、よくアスベストに暴露することで患うがんとして知られていますが、その原因遺伝子はほとんどがん抑制遺伝子です。ですから阻害剤タイプの抗がん剤をつくることが難しい。そこで私たちは、“合成致死”という方法を用いて、がんの原因遺伝子と関連がとても深い、パートナーとなる遺伝子の阻害剤をつくることで、がん抑制遺伝子が変異している、つまりブレーキが壊れている遺伝子に特異的に効くような薬がつくれないかと取り組んでいます。
先ほどの“合成致死”で説明したように、がんの場合、2つある遺伝子AとBのうちの片方が変異して、がんの原因遺伝子になっています。Aの遺伝子に変異があり、Bが正常だとすると、“合成致死”のパートナー遺伝子であるBの遺伝子を見つけて、それを阻害する薬を投与すれば、AとBの両方が変異して細胞は死にます(合成致死)。ですがAもBも変異のない正常細胞は、例えBが阻害剤で阻害されても、Aは変異していないので細胞は死にません。この仕組みにより、がん細胞のみを特異的に攻撃し、副作用が非常に少ない抗がん剤ができるのではないかと考えています。
現状、研究室では合成致死に至る遺伝子の組み合わせの候補をいくつか見つけているので、今度はそれらを細かく調べて、実際にどれが合成致死に至る組み合わせなのかを調べていきます。さらに、どのような分子機構でその細胞が死んでいるのか、どうしてその2つの遺伝子の組み合わせだと細胞が死ぬのかということも解明していくつもりです。
■では「診断法開発」の研究についても教えてください。
これはまだ始めたばかりの研究ですが、着眼点としては、がんがヒトの命を奪う病気であるのはなぜかということです。例えば、おできのような出来物は、その部分の細胞がたくさん増えて隆起します。ですがその場所から動かないので、外科的に切除でき、それが最も根本的な治療になると言えるでしょう。一方、がんが命を奪う大きな理由のひとつは、転移することにあります。最初に発現した場所ではなく、脳や肺、腹腔など、色々な場所で増えてしまい、外科的にも取り切れず、抗がん剤や放射線治療も効かないという状態に陥るわけです。がんが転移する際は、もともとがん細胞があったところから、わずかながん細胞が血管に入り、血流に乗って全身をまわり、それによって脳内の毛細血管や肺の細い血管に詰まり、そこで増えて転移するということがわかっています。ですから、がんの切除手術後、きちんとがんが取り切れているか、転移していないかを血液を採取して調べられるようにしようということが、この研究の目的になります。
もちろん医療現場では、がんの切除手術後、定期的に患者さんの血液を検査し、がんが転移していないかを調べてはいます。その時に使用されるものが、バイオマーカーです。これは、がんになると血液中に増えてくるたんぱく質に特徴的なものや非特徴的なものがあり、その組み合わせによってがんを診断するものです。また、がんには特異的な遺伝子変異があるので、それが表れているDNAを血液中から検出して、がんが増えているかどうかを診断したりもします。
それに対して、この研究室では、がん細胞が特異的に発現している酵素に反応する試薬を利用して、血液中にあるわずかながん細胞を検出しようと取り組んでいます。具体的には、特定のがん細胞にだけ染まって蛍光する化学物質を使い、がん細胞を検出する方法を開発しようと研究しているところです。細胞をより分ける機械にかけて、蛍光している細胞とそうでない細胞に分け、光っている細胞が多ければ、がん細胞が血液中に流れ出ているので転移している可能性があると判断できるというものです。これは、がんを示す物質がある程度、増えてからでないと検出できないバイオマーカーに比べて感度が高いので、早い段階でがんの転移を示すものを検出できるのではないかと考えています。現状、試薬が最も染まりやすく、ノイズの少ないがん種の選定を進めているところです。
■先生がこの分野に興味を持ったきっかけとは? また、どんなところに研究の面白さを感じていますか?
大学時代は薬学部で、今、手掛けているような生化学系分野を学んでいました。私のいた大学の薬学部は、薬剤師の資格は取得しても、卒業後に薬剤師として働く人は少ないところで、研究がメインの学校でした。それも創薬に直結した研究というよりは、もっと基礎的な研究をしている研究室が多く、そこで基礎研究をしているうちに自然と私も研究がしたいと思うようになり、研究者を目指すようになったのです。
大学院に入った頃は、遺伝学を使う研究をしていました。酵母やショウジョウバエ、線虫といった遺伝子組み換えが簡単にできて、そのシステム自体はヒトにすごく似ているモデル生物を使った研究です。そのときのテーマが、細胞がどう分裂して、どう増えていくのかという細胞周期だったことがひとつのきっかけだと言えます。また、私のバックグラウンドとしては、薬学部だけでなく医学部でも学んだので、薬剤師の資格に加えて医師の資格も持っています。ですから、モデル生物を使った細胞周期の基礎研究を医療分野で活かそうとすると、やはりがんが一番分野として近かったのです。がんは細胞周期がおかしくなり、細胞がどんどん増えていく病気ですからね。ですから、がん研究に遺伝学を使えないかということで、細胞の仕組みを調べていたときに使っていた手段である“合成致死”を用いて、すでに承認されている乳がんや卵巣がんの薬剤以外のがんに使えないだろうかということで、研究を始めました。
研究では、創薬を目指しつつ、生物に共通するシステムを見つけられたらと思っています。例えば、モデル生物のひとつである酵母は、2種類の酵母が実験によく用いられます。その2種類の酵母の遺伝子の進化的な離れ具合と、ヒトの遺伝子と酵母の遺伝子の離れ具合はほぼ同じだと言われています。例えば、細胞周期をまわすエンジンが壊れている酵母に、ヒトの細胞周期をまわすエンジンを入れてあげると回復するという研究結果があるくらいです。この成果は2001年のノーベル賞受賞に繋がっています。このように全く違う生物間でも、保存されている共通のシステムを明らかにできることに、とても面白みを感じています。
■今後の展望をお聞かせください。
今、お話ししたように、生物の共通システムをひとつでも見つけたいという思いがありますし、それは創薬研究にも生命科学の分野にもどちらにも有益だと思っています。
また、今日は取り上げませんでしたが、今、薬剤耐性の研究も進めています。薬剤耐性とは、長く抗がん剤などの薬を飲んでいると、だんだん効かなくなるということです。そのメカニズムを調べて、なぜそれが起きるのかを明らかにしようと考えています。
薬剤耐性が起こる理由については、すでにわかっていることもあります。ひとつは細胞からその薬剤をくみ出すようなたんぱく質が発現して、同じ用量では効かないという場合もありますし、その薬によってある経路は阻害できているけれど、別の経路が活性化してしまい、薬を投与しても意味がないということもあります。他にも理由があると思いますから、薬剤耐性の原因を明らかにすることで何らかの解決策を考えられるよう貢献していければと取り組んでいます。
■学生を指導するうえで、大事にしていることはありますか?
4年生で研究室に配属される前までは、学生は講義や実習で、答えのわかっていることを学びます。しかし4年生になると、卒業研究を通して、誰も答えを知らないことを実験して確かめるという挑戦が始まります。誰も答えがわからないことに取り組むので、当然、うまくいくことよりもうまくいかないことの方が多いです。そういうときに、どうしたらよいのかという対処法を身に付けてほしいと思って指導しています。例えば、研究室の先輩や先生に聞いたり、自分で調べたりというように、自ら解決に向けて動く姿勢を身に付けてほしいのです。
また、研究室では、学生にとにかく質問をするように促しています。完璧にわかっていなければ、何らかの質問は必ずあると思いますが、学生はそれまでずっと受け身で学んできたせいか、質問することを恥ずかしがったり、こんな質問をしてよいのかどうかと戸惑ったりしているようで、なかなか質問をしません。ですが社会に出ると、会議などで質問できない人はいないのも同然の扱いをされることがあります。学生のうちは、どんな質問にも教員は答えてくれると思いますし、数をこなさないとよい質問は出てこないと思うので、勇気を持って、能動的に質問できるようになってほしいですね。それは社会人になったときにも役立つスキルだと思います。
■最後に受験生・高校生へのメッセージをお願いします。
私が受験生・高校生のみなさんに言えることがあるとすれば、苦手科目だからと進路を諦めるのではなく、科目は苦手でも興味の強い分野に進んだ方が長続きするのではないかということです。かく言う私は、物理も数学もすごく苦手で、周囲から「よく理系に進んだな」と驚かれるほどでした。私自身は理系科目に対する適性がなかったわけですが、学問として見ていくと生物や生化学にはとても興味があったので、周囲の声に囚われず、理系の進路を選んだのです。
また2019年に本学へ着任して以来、応用生物学部は先生同士のコミュニケーションがとても盛んで、先生と学生の距離もすごく近いということを実感しています。ですから本学部に入学したら、研究室の配属を待たずに、低学年の頃からどんどん研究室に出入りして、色々な研究の話を聞いてほしいですね。そうすると早い段階で、自分がどんなことに興味があるのかを知ることができますし、自分から積極的に動いていけば、教員はどなたでも温かく迎えて、応援してくれると思います。学生がそんなふうに興味を持って扉をたたいてくれることは、教員にとってもうれしいことですから。そういうオープンな環境があることは、応用生物学部の魅力のひとつだと思います。


