DNAなどの生体分子を応用して、病気の診断に役立てる研究を進めています。
応用生物学部 加藤 輝 教授

遺伝子診断技術の開発やDNAアプタマーの応用研究に取り組んでいる加藤先生。もともとは化学がご専門ということで、化学の知識を生命科学分野に役立てる研究に力を入れています。今回は、前回の掲載で紹介した研究のその後の展開を中心にお話しいただきました。
過去の掲載はこちらから→ https://www.teu.ac.jp/interesting/014548.html
■前回の取材では、遺伝子の配列の違いを調べる研究やDNAアプタマーの研究について伺いましたが、今、研究室ではどういう研究が進んでいるのですか?
今回は、以前お話ししたDNAアプタマーの研究の現状と、3年ほど前からスタートしたDNAのメチル化を検出する研究についてお話ししたいと思います。
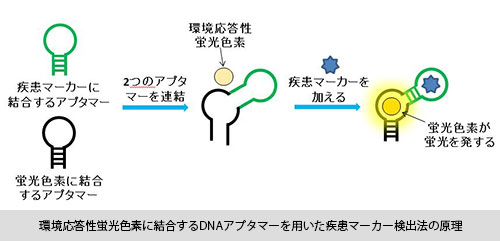
DNAアプタマーというのは、タンパク質と似たつくりのDNAから人工的につくりだした人工核酸のことで、体内を病原菌などから守る“抗体”のように、何か特定の狙った物質に結合することができます。このDNAアプタマーを、例えば、病気に関連するようなタンパク質の検出に使えるよう工夫を施すというのが、今、当研究室で取り組んでいる研究になります。病気に関連するタンパク質とは、いわゆる疾患マーカーと呼ばれるものです。例えば癌の場合、腫瘍マーカーと呼ばれるものがあって、癌を患うと血液中にそれが生じると知られています。その腫瘍マーカーと結合するDNAアプタマーに独自の工夫を施して、診断技術として利用しようと取り組んでいます。
具体的な話をすると、腫瘍マーカーに結合するDNAアプタマーはすでにあるのですが、既存のアプタマーでは、腫瘍マーカーと結合したかどうかを知ることができません。ですから“結合した”というシグナルを、どのようにして受け取るかということが重要な問題なのです。もし、その部分で大がかりな装置が必要になったり、時間がかかったりすると、手軽な診断としては使えません。そこで私たちは“蛍光”という方法を用いて、結合を検知できるようにしようと取り組んでいます。蛍光は、バイオテクノロジーや診断技術において、一般的に使われているシグナルです。それを利用して、腫瘍マーカーとDNAアプタマーが結合したとき、独自の方法でピカッと光り、結合を知らせてくれるものをつくっています。どういうところが“独自の方法”かというと、実は蛍光に関してもDNAアプタマーを使っているのです。つまり、腫瘍マーカーに結合するDNAアプタマーと、蛍光色素に結合する当研究室でつくりだした独自のDNAアプタマー、これら二つを組み合わせて使っています。ここでの蛍光色素は、環境応答性蛍光色素というやや特殊なもので、通常の状態では光っていません。光る仕組みとしては、まずDNAアプタマーが腫瘍マーカーに結合し、その結合によって、そこに繋がっている蛍光色素と結合するDNAアプタマーの構造が変化し、その構造変化したDNAアプタマーが蛍光色素と結合して光ります。それが一瞬で起きるのです。

■この研究はどのくらい進んでいるのですか? また、DNAアプタマーを腫瘍マーカーの検知に用いることは、どのような利点があるのでしょうか?
今のところ、試験管レベルで成功している状況です。ですから、実際にこの方法で腫瘍マーカーを検出するには、もう少し検出の感度を上げる必要があります。また、血液や血清を使って行う場合は、そこに不純物が含まれているため、その影響をどう排除するかということも考えなければなりません。ただ、このDNAアプタマーの研究が実用化すれば、今よりも腫瘍マーカーの検知は早くなります。現在、腫瘍マーカーの検知には、抗体やクロマトグラフといった手法が用いられています。血液を採取して、数日後、早ければ数時間後には結果が出ますから、それでも問題はありません。しかし、もっと早く結果がほしい状況もあるわけです。例えば、手術中にすぐ調べたいとか、研究中に細胞の表面に腫瘍マーカーが存在するかどうかをすぐ知りたいといった場合です。ですからこの研究は、今までの方法ではできないことが、できるようになる可能性があると言えます。
■では、DNAのメチル化を検出する研究とは、どのようなものですか?
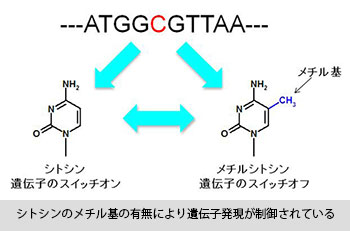
簡単に言うと、DNAを構成するA(アデニン)、T(チミン)、G(グアニン)、 C(シトシン)という4つの塩基のうち、C(シトシン)にメチル基がついているかどうかを検出する方法について研究しています。シトシンにメチル基がついているか否かは、遺伝子が働くかどうかを決めるスイッチのような役割をしていて、メチル基がついていれば、その遺伝子はオフ、ついていなければオンの状態になっていると言えるのです。例えば、人はもともと誰でも癌を抑制する遺伝子を持っているのですが、その抑制する遺伝子のスイッチがオフになっていると、癌の初期状態である可能性が高いと言えます。つまりシトシンのメチル基の有無は、癌の早期発見に繋がる診断技術に利用できるというわけです。研究の状況としては、約100塩基の長さのDNAにある、ひとつのシトシンにメチル基がついているかどうかを検出できるようになりました。検出感度も十分、実用化レベルになっています。具体的に言うと、血液が数mℓあれば検出できる感度です。ただし、これもまだ試験管レベルでうまくいっている状況で、実際のヒトの遺伝子を使った実験はできていません。今後、そうした段階を確実に経て、実用化を目指していきたいと思っています。
■最後に、今後の展望をお聞かせください。
私はもともと化学出身ですから、そこにこだわって研究したいと思っています。ですから化学をバイオテクノロジーの中で、いかに役立てていくということは、今後も変わらず続けていきます。また、当然ながら自分の研究成果が、世の中の役に立つことを願っています。学部の名前にあるように「応用生物学部」の「応用」というのは、やはり基礎的な内容を実用化するということを意味していると思うので、その“実用化”という部分にもこだわりって研究していきたいですね。
それから研究の展望としては、最初にお話しした蛍光を発するDNAアプタマーの研究で、細胞の表面や中にある様々な物質を検出していきたいと思っています。大きく言えば、生命現象をリアルタイムで目に見えるようにすることで、今までわかっていなかった生命現象の様々を理解していきたいなと。化学的な視点から言うと、例えば生物はみな化学物質でできているので、一つひとつの化学物質が細胞の中で動いています。そういう生命現象が、どう動いているのかを見ていきたいと考えています。中でも特に注目しているのは、ノンコーディングRNA(ncRNA)。これはタンパク質をコードしない、要はタンパク質を合成する反応をしないRNAのことで、その機能は、まだよくわかっていません。ですから、まずはRNAを目で見えるようにしたいなと思っています。
■生体機能化学(加藤輝)研究室
https://www.teu.ac.jp/gakubu/bionics/index.html
・次回は3月8日に配信予定です。


